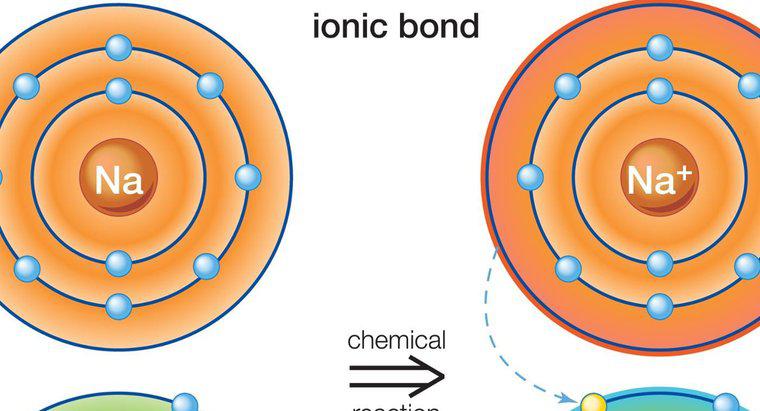
Os compostos iônicos são sólidos, possuem altos pontos de fusão, conduzem eletricidade, são duros, mas quebradiços e são formados por uma ligação iônica entre um metal e um não metal. Uma ligação iônica é uma ligação entre dois elementos com cargas opostas. As cargas opostas se atraem, criando uma forte ligação química.
Os compostos iônicos se dissolvem facilmente em solventes polares, como a água. Eles não se dissolvem prontamente em solventes não polares, que incluem éter e gasolina. Isso ocorre porque os compostos iônicos tendem a formar moléculas polares, que se dissolvem em soluções de polaridade semelhante. Um solvente apolar não fornece energia suficiente para quebrar a ligação iônica e dissolver a estrutura cristalina do composto.
As propriedades condutoras dos compostos iônicos se aplicam quando eles são dissolvidos em uma solução iônica ou quando são derretidos. Quando os compostos iônicos são sólidos, eles são isolantes elétricos em vez de condutores. Isso ocorre porque as cargas elétricas não podem passar pela estrutura de rede rígida de um composto iônico em seu estado sólido.
Cloreto de sódio, também conhecido como sal de cozinha; cloreto de potássio, que é usado na medicina e como substituto do sal; e o corindo, o mineral de que são compostos os rubis e as safiras, são compostos iônicos bem conhecidos. Todos esses compostos formam estruturas cristalinas, outra característica comum dos compostos iônicos.