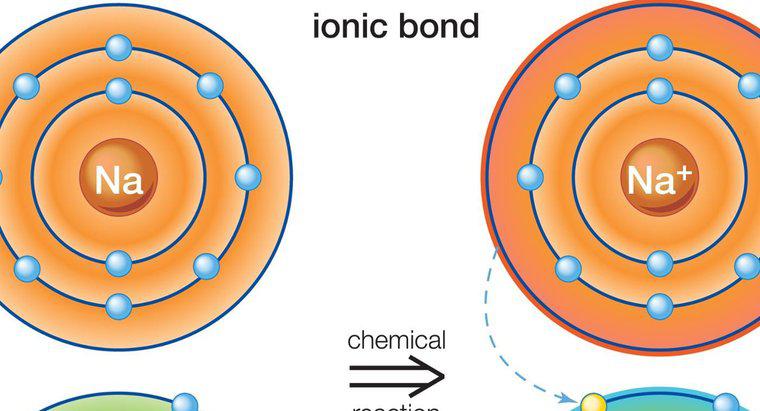
A ligação iônica envolve um metal e um não-metal. Isso ocorre porque a ligação iônica envolve a transferência de elétrons de valência. A ligação resultante cria dois íons com cargas opostas.
A ligação iônica ocorre entre metais e não metais porque os metais têm poucos elétrons no anel externo. Isso torna os metais mais prontos para perder elétrons, pois isso fará com que o íon obtenha uma configuração estável. Alguns não-metais têm cerca de oito elétrons e requerem mais elétrons para obter a configuração de gás nobre.
Mais de um elétron pode ser compartilhado entre os elementos. Conforme um elemento ganha e outro perde, isso faz com que um elemento fique carregado positivamente e o outro negativamente. Se o elemento se torna positivo ou negativo depende se eles perderam ou ganharam elétrons. Uma perda levará a uma carga positiva, enquanto um elétron adicional levará a uma carga negativa. A carga líquida no composto deve ser zero. Como são sempre os elétrons doadores de metal, o elemento metálico é positivo e o elemento não metálico é negativo.
Um exemplo de ligação iônica é o composto de cloreto de sódio, comumente conhecido como sal de cozinha. O sódio contém um elétron em seu anel externo, enquanto o cloro contém sete. O sódio transfere seu elétron para o cloro e fica com carga positiva, enquanto o cloro fica com carga negativa. A carga líquida do composto é zero, pois os dois elementos estão ligados.