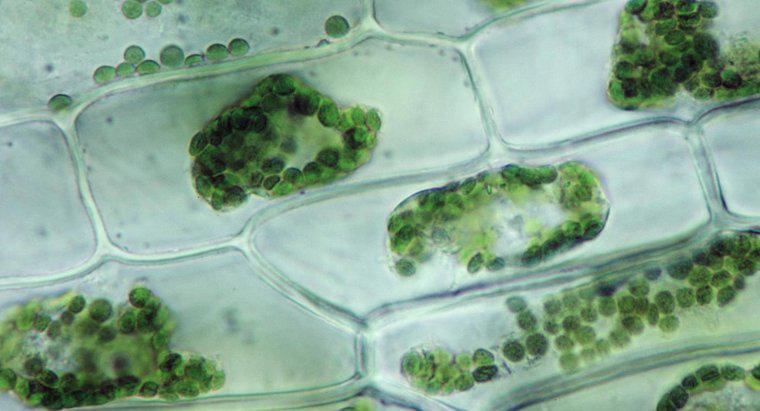
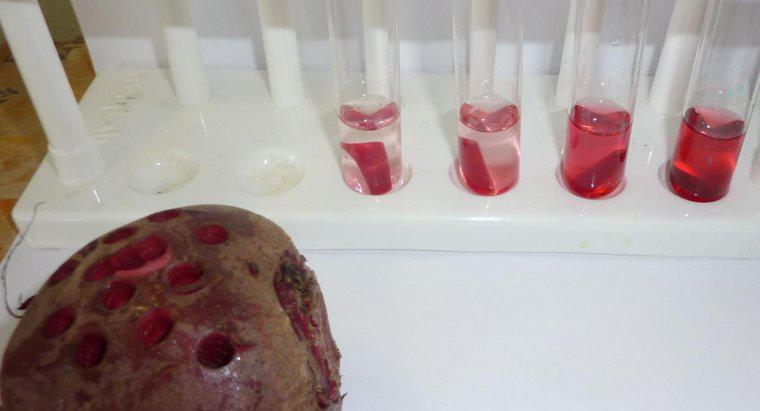
A osmose é um tipo particular de difusão em que a água atravessa uma membrana semipermeável para uma área com uma concentração de soluto maior, enquanto a difusão padrão muitas vezes permite o movimento livre de solutos e solventes em direção ao equilíbrio. Difusão em geral é o movimento líquido de moléculas em solução de áreas de concentração mais alta para áreas de concentração mais baixa. A pressão osmótica é potencialmente muito poderosa, sendo a pressão osmótica a única força necessária para mover a água das raízes até o topo das árvores mais altas do mundo.
Quando a água dissolve outra substância, é porque as moléculas polares de água e o soluto se atraem. Cada átomo, íon ou molécula de soluto tem uma carga em pelo menos uma região que atrai um ou outro lado da molécula de água. Como tal, tantas moléculas de água quanto possível tendem a se reunir em torno de cada partícula de solvente. Na água líquida, todas as moléculas estão em movimento aleatório e constante em torno umas das outras. No entanto, por causa da atração, as moléculas de água são ligeiramente mais propensas a se moverem em direção às partículas de soluto do que para longe delas, e as partículas de soluto são mais propensas a se moverem em direção às moléculas de água do que outras partículas de solvente. Este movimento líquido resulta, gradualmente, em uma distribuição uniforme do soluto. Na osmose, apenas as moléculas de água podem se mover para equalizar as concentrações.