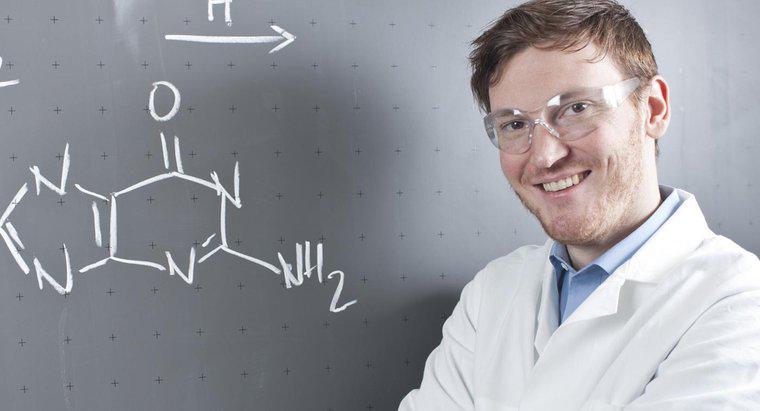
Os subscritos em uma equação química são o número no lado direito inferior de um elemento químico que diz a um químico quantos átomos desse elemento estão presentes na equação. Por outro lado, os sobrescritos em uma equação química são as notações para uma carga iônica positiva ou negativa.
Essas notações químicas são críticas para equilibrar uma equação química e entender o resultado da combinação de certas substâncias. Por exemplo, se uma equação química tem três átomos de oxigênio à esquerda, o lado direito deve terminar com três átomos de oxigênio (até que os coeficientes sejam introduzidos). Os subscritos nunca devem mudar de um lado para o outro da equação. As equações químicas são semelhantes às equações matemáticas e tudo deve ser contabilizado para ter uma fórmula completa.
Um exemplo útil é a água. Água é escrita como H2O, mas com os dois como um subscrito à direita do H. Os dois representam dois átomos de hidrogênio que estão ligados ao oxigênio.
Da mesma forma, os sobrescritos também devem manter o equilíbrio nas equações químicas. Os sobrescritos informam aos cientistas qual carga iônica o átomo possui. Se for positivo, é um cátion. Se for negativo, é um ânion.