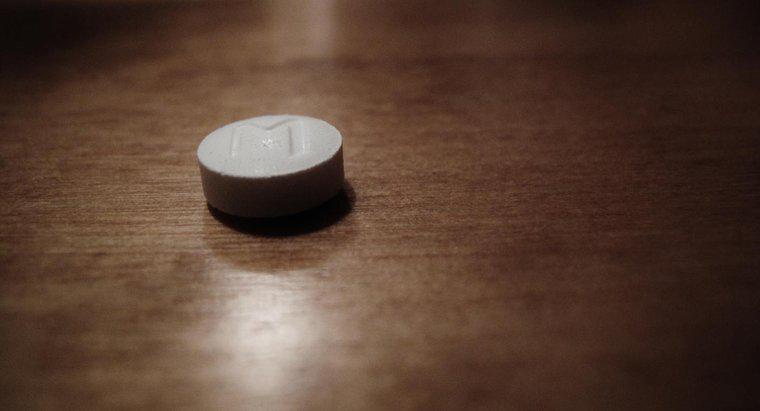
Os químicos escrevem a estrutura de Lewis do íon hidróxido como HO com um conjunto adicional de 3 pares de elétrons em torno do oxigênio, um par na posição de 12 horas, um segundo par na posição de 3 horas e o par final na posição das 6 horas. O íon inteiro é então cercado por colchetes com um sinal negativo no canto superior direito, representando a carga iônica geral.
As estruturas de Lewis envolvem escolher o átomo central e escrever seu símbolo. As regras determinam que ele deve ter a menor eletronegatividade. A eletronegatividade diminui na tabela periódica de cima para baixo e da direita para a esquerda. Outros átomos no íon ou composto se conectam com um traço para representar uma ligação simples; no entanto, às vezes é necessário mudar para ligações duplas ou triplas para completar a estrutura.
Os alunos geralmente não desenham estruturas de Lewis para elementos além do período 4, que requerem elétrons adicionais para preencher sua camada externa, então eles são capazes de usar a regra do octeto. Ele afirma que, com exceção do hidrogênio e do hélio, os átomos com 8 elétrons na camada externa são estáveis.
A estrutura representa o número de elétrons que cada átomo doa como pontos ao seu redor. Alguns átomos não fornecem elétrons suficientes para satisfazer a regra do octeto, exigindo ligações duplas ou triplas. Cada ligação representa dois elétrons.
Uma vez que os elétrons estão em seus lugares, o cientista desenha colchetes ao redor de toda a estrutura. Um sinal sobrescrito à direita do último colchete representa qualquer carga em um íon.