À temperatura ambiente e à temperatura atmosférica normal, o cloro é um gás verde-amarelo com densidade mais pesada que o ar. Baixar a temperatura para menos 29 graus Fahrenheit ou aumentar a pressão a converte em amarelo líquido. O cloro é altamente reativo e não existe como um composto puro na natureza.
O cloro gasoso consiste em moléculas de cloro, que são dois átomos de cloro quimicamente ligados um ao outro. Quando exposto a qualquer elemento que não seja gases nobres, o cloro reage para formar um cloreto. Se o outro elemento for um metal, o cloreto geralmente é de natureza cristalina.
O nariz humano é capaz de detectar cloro em níveis acima de 3,5 partes por milhão. Quando a concentração no ar está acima de 1.000 partes por milhão, o gás causa a morte de humanos em questão de segundos. É um irritante respiratório para as membranas mucosas. O cloro causa queimaduras na pele. Os militares usaram cloro como gás de guerra em 1915.
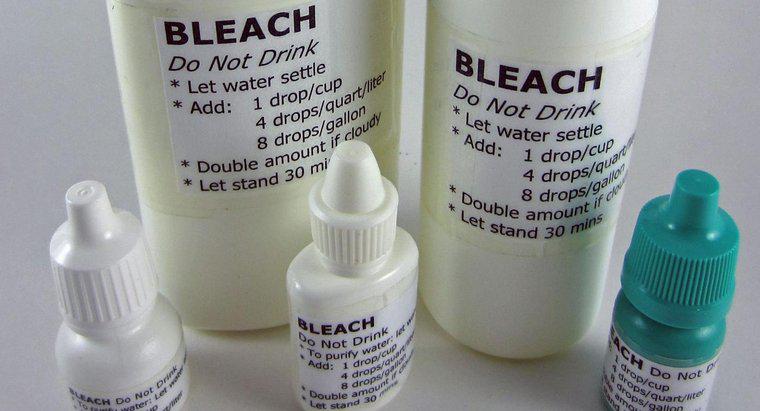
O cloreto de sódio ou sal de cozinha é a fonte mais abundante de cloro. Os laboratórios costumam usar cloro na forma de ácido clorídrico. Os consumidores usam cloro na forma de alvejante para roupas. Na indústria, branqueia a celulose na produção de papel. Os fornecedores municipais de água usam cloro para desinfetar a água potável.