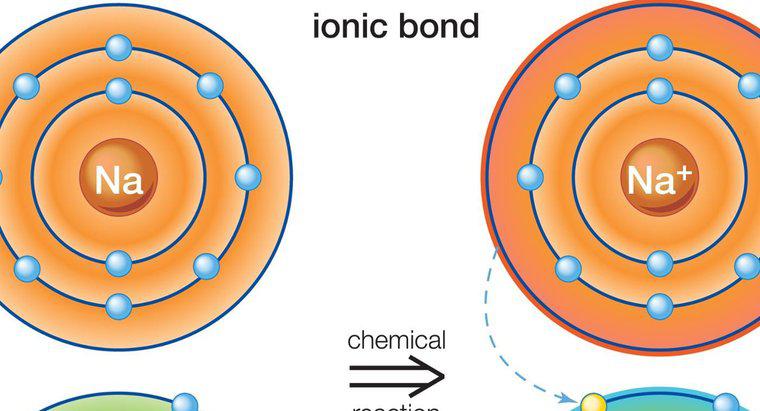
Os compostos iônicos e moleculares diferem principalmente na maneira como são formados. Os compostos iônicos se formam por meio da transferência de elétrons, enquanto os compostos moleculares se formam como resultado do compartilhamento de elétrons.
Os compostos iônicos contêm átomos e moléculas com cargas opostas. Eles se unem como resultado de suas cargas opostas. Por exemplo, um íon emparelhado negativamente se liga a um íon positivo. Átomos e moléculas com cargas semelhantes se repelem. As moléculas com carga positiva são chamadas de cátions e as moléculas com carga negativa são chamadas de ânions.
Compostos Iônicos
Os compostos iônicos se formam como resultado de átomos ou moléculas que atraem mais átomos ou moléculas com carga oposta. A composição varia dependendo do tipo de composto, mas todos os compostos iônicos devem ter uma carga elétrica neutra. Isso significa que eles devem ter uma proporção igual de moléculas aniônicas e catiônicas.
Os compostos iônicos são normalmente sólidos. Eles podem ser feitos de átomos únicos, chamados de compostos monoatômicos, ou de átomos múltiplos, o que os torna compostos poliatômicos. A ligação iônica, que forma moléculas iônicas, envolve a transferência de elétrons de metais para não metais. Os metais tendem a perder elétrons positivos prontamente porque têm poucos elétrons em seu nível de energia externo. Os não-metais têm mais elétrons negativos em seu nível de energia externo. Como resultado, eles buscam íons positivos e se ligam naturalmente às moléculas metálicas. A maioria dos compostos poliatômicos são aniônicos, com exceção do cátion amônio. Os compostos iônicos diferem dos compostos moleculares porque podem se formar a partir de metais e não metais, enquanto os compostos moleculares só podem se formar a partir de não metais. Tipos comuns de compostos iônicos são sal e açúcar.
Compostos moleculares
Os compostos moleculares, também chamados de compostos covalentes, compartilham elétrons formando ligações covalentes. Enquanto os compostos iônicos podem consistir em átomos e moléculas metálicos e não metálicos, ligações covalentes só podem se formar a partir de átomos e moléculas não metálicos. Um composto covalente é formado quando átomos dentro de diferentes elementos são combinados por meio de moléculas. Essa ligação permite o compartilhamento de elétrons de valência, o que cria uma atração comum que mantém os átomos da molécula juntos.
Os compostos covalentes variam consideravelmente em tamanho. Alguns são pequenos, com apenas alguns elementos, enquanto outros podem ter milhares de átomos. Como eles compartilham elétrons em vez de trocá-los, os compostos covalentes têm propriedades consideravelmente diferentes dos compostos iônicos. Os compostos covalentes tendem a queimar facilmente, enquanto os compostos iônicos não. Em contraste com os compostos iônicos, eles não são solúveis em água. Outra distinção entre os dois tipos de moléculas é que os compostos covalentes não podem conduzir eletricidade, mas os compostos iônicos geralmente podem. À temperatura ambiente, a maioria dos compostos covalentes estão na forma líquida ou gasosa em vez de aparecerem como sólidos. Isso se deve ao fato de que suas moléculas individuais são mais facilmente separadas do que as moléculas em um cristal, o que lhes dá um ponto de ebulição relativamente baixo. Compostos moleculares simples têm a mesma estrutura de nome. Eles são encontrados na tabela periódica nomeando o elemento que aparece mais à esquerda na tabela primeiro, depois adicionando "ide" ao segundo elemento nomeado e usando prefixos para identificar o número de átomos em cada elemento. Proteínas e carboidratos são dois exemplos de compostos moleculares. Outros compostos moleculares incluem gás metano, óxido de nitrogênio e cloreto de sódio.