A carga total ou líquida de qualquer composto iônico deve ser igual a zero. Embora os próprios íons sejam positivos (cátions) ou negativos (ânions) por definição, a única maneira deles podem se ligar e formar um composto é buscando uma carga oposta.
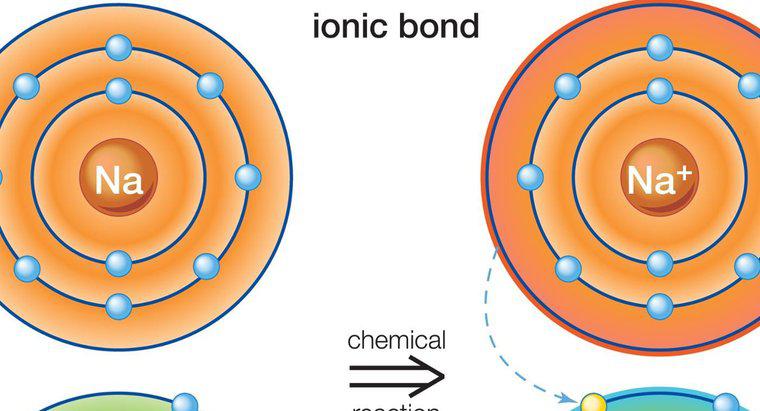
Um composto iônico em química refere-se a qualquer composto químico no qual os íons são mantidos juntos, ou ligados, por meio de ligações iônicas. As ligações iônicas, por definição, são atrações eletrostáticas entre dois íons com carga oposta. Em outras palavras, uma ligação iônica só pode se formar entre um cátion e um ânion.
Embora não haja limite para o número de íons contidos em um composto iônico, para que o composto permaneça inteiro, a carga líquida precisa ser igual a zero. Portanto, deve haver um número igual de cátions e ânions dentro do composto completo.
Um exemplo popular e comum de um composto iônico que exibe esse princípio é o sal de cozinha ou cloreto de sódio, que tem a fórmula química NaCl. A formação do sal de cozinha é o resultado de uma ligação iônica entre um cátion sódio, Na + e um ânion cloro, Cl-. A estrutura de cada íon é diferente de um átomo do mesmo elemento (Na ou Cl) que mantém uma carga neutra devido a um número igual de prótons e elétrons. Somente quando cada átomo se torna um íon é que ele é capaz de se ligar ao outro átomo e criar um composto iônico.