Os átomos envolvidos na ligação iônica são mantidos juntos por uma força eletrostática de atração entre um íon positivo e um íon negativo. As ligações iônicas são formadas apenas entre metais e não metais.
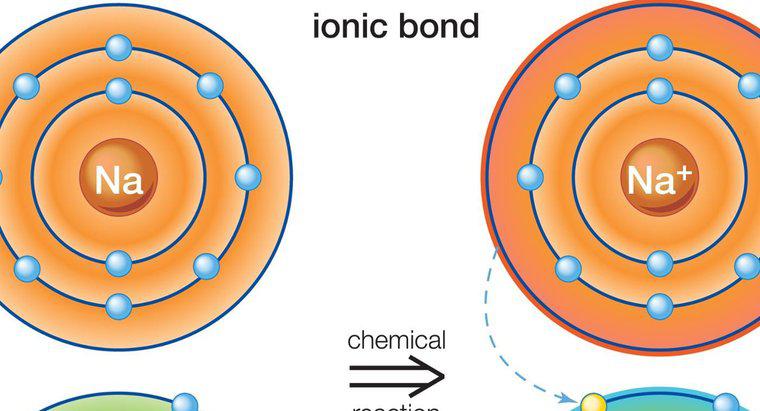
A ligação iônica ocorre na presença de um íon positivo e um íon negativo. Os íons são formados quando os átomos neutros perdem ou ganham um elétron. Todos os átomos perdem ou ganham elétrons para atingir uma configuração eletrônica estável. Os gases mais estáveis e nobres, todos têm oito elétrons em suas camadas mais externas, com exceção do hélio, que tem apenas dois elétrons. Quando um átomo tem oito elétrons em sua camada externa, diz-se que tem uma estrutura de octeto estável.
Os metais têm de um a três elétrons em suas camadas externas, o que os impede de formar uma estrutura de octeto estável. É mais fácil para os átomos perderem elétrons para revelar uma camada subjacente com oito elétrons, em vez de ganhar elétrons para completar a estrutura do octeto. Portanto, os metais formam íons positivos. Os não-metais, no entanto, tendem a ganhar um ou mais elétrons para completar o octeto em sua camada mais externa e, portanto, tendem a formar íons negativos.
Os metais podem doar seus elétrons para não metais. Como as cargas dos íons são diferentes (íons de carga oposta), o átomo de metal carregado positivamente é mantido no átomo não metálico de carga negativa com uma forte força de atração eletrostática.