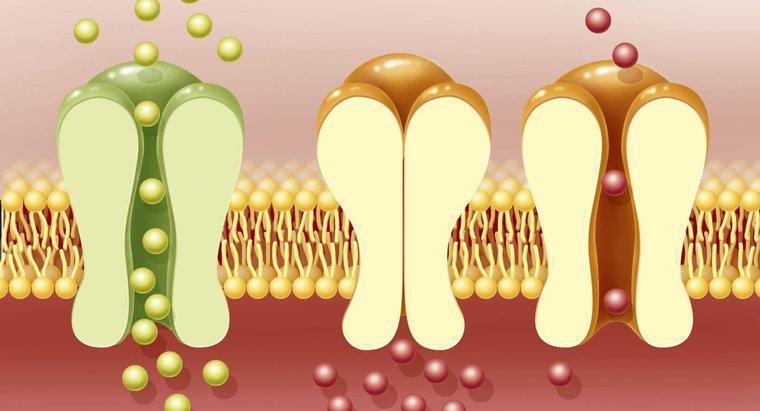
Os elementos químicos com maior probabilidade de formar ligações covalentes são aqueles que compartilham elétrons, como o carbono, em oposição àqueles que os retiram de outro elemento para formar uma ligação iônica. Em geral, eles são não metais com eletronegatividades semelhantes. Eles estão localizados no centro da tabela periódica, de acordo com HowStuffWorks.
A forma mais pura de uma ligação covalente existe em gases diatômicos. Hidrogênio, oxigênio, nitrogênio e halogênios formam todos esses tipos de ligações. Ao compartilhar um elétron, eles satisfazem a regra do octeto para ambos os átomos. Como os átomos têm a mesma eletronegatividade, o elétron compartilhado tem a mesma atração para ambos.
Os materiais orgânicos da ligação carbono-hidrogênio requerem uma ligação covalente. Esses dois elementos formam longas cadeias que às vezes se ramificam e têm grupos funcionais ligados à cadeia. Romper a ligação covalente requer energia. Em contraste, muitos compostos iônicos se dissociam facilmente quando dissolvidos em água.
Nas ligações covalentes polares, os dois átomos continuam a compartilhar o elétron, mas devido às diferenças na eletronegatividade, um átomo tem mais atração pelo elétron compartilhado do que o outro. O empate não é forte o suficiente para criar uma situação iônica. Este é o tipo de ligação observada na água. Como resultado, as moléculas de água têm uma extremidade positiva e uma extremidade negativa, tornando-se um solvente polar e dando-lhe a capacidade de dissolver compostos iônicos.