A ligação de hidrogênio envolve as mudanças de dipolo criadas por ligações polares e ocorre entre as moléculas que contêm ligações polares. O hidrogênio está especificamente envolvido porque o elemento tem uma baixa eletronegatividade para um não metal e cria um grande deslocamento de dipolo que é forte o suficiente para atrair outros átomos eletronegativos de ligações polares em outras moléculas.
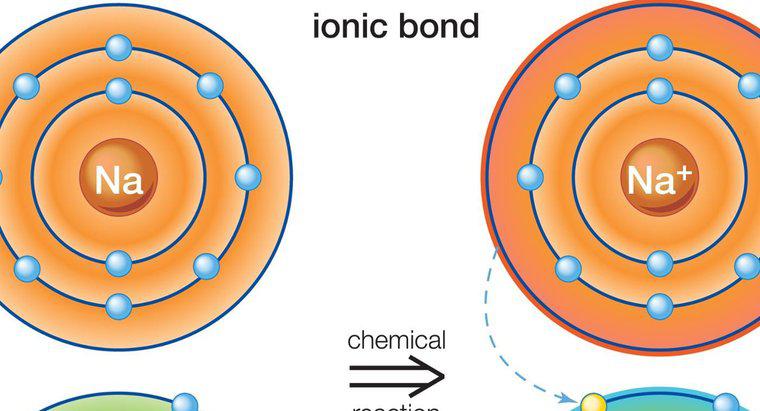
As ligações covalentes polares se formam quando a ligação dos dois átomos tem uma diferença na eletronegatividade que é significativa o suficiente para criar uma mudança na carga, mas é menor do que a diferença necessária para formar uma ligação iônica. Em uma ligação covalente polar, os átomos compartilham os elétrons de maneira desigual. Isso cria uma mudança de dipolo e dá a uma extremidade uma carga ligeiramente positiva e à outra uma carga ligeiramente negativa.
Quando o hidrogênio está envolvido em uma ligação polar, ele se torna levemente carregado positivamente e atrai dipolos carregados negativamente de outras moléculas. A outra molécula não precisa ser polar em geral, mas deve ter ligações polares para formar os dipolos que atraem ou repelem as cargas de hidrogênio. A ligação de hidrogênio é uma forma mais fraca de ligação do que as ligações iônicas ou covalentes, mas é significativa o suficiente para criar propriedades exclusivas e forças de atração, como as observadas entre as moléculas de água.