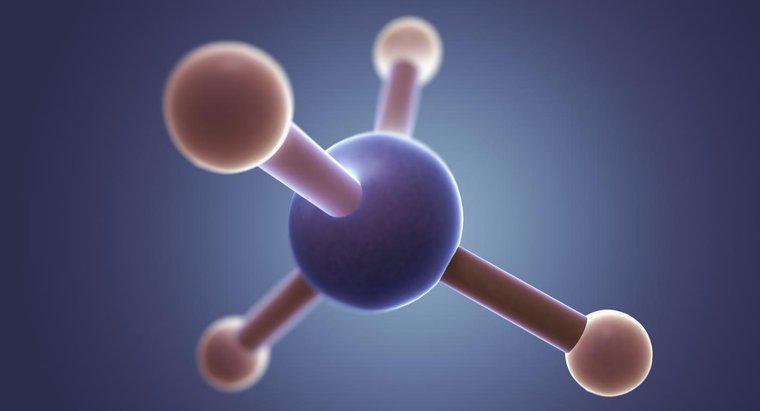
A estrutura de pontos de Lewis para CH2F2, a fórmula química do difluorometano, é um C no centro com linhas em cada lado dos dois H's e dos dois F's. Cada H contém 3 pares de pontos em torno dos lados não ligados.
Na estrutura de Lewis, o C representa o carbono, o H representa os dois átomos de hidrogênio, o F representa os dois átomos de flúor, os pontos representam os elétrons e as linhas representam um par ligado de elétrons. Cada átomo de flúor contém sete elétrons de valência. Este número pode ser determinado pela coluna de flúor na tabela periódica. Cada átomo de carbono possui quatro elétrons, também mostrados por sua coluna na tabela periódica. Para se ligar a dois átomos de flúor, o átomo de carbono deve criar uma ligação simples com cada átomo de flúor, usando seus elétrons de valência. Um dos sete elétrons de valência dos átomos de flúor se liga ao único elétron do átomo de carbono, deixando cada átomo de flúor com seis elétrons de valência não ligados restantes. Na estrutura de pontos de Lewis, esses elétrons restantes são representados por pontos colocados igualmente ao redor do símbolo dos elementos. Para verificar a precisão da estrutura de pontos de Lewis, os alunos podem contar todos os elétrons, contando cada ponto como um elétron e cada ligação como dois elétrons. O número de elétrons na estrutura deve ser igual ao número de elétrons em CH2F2.