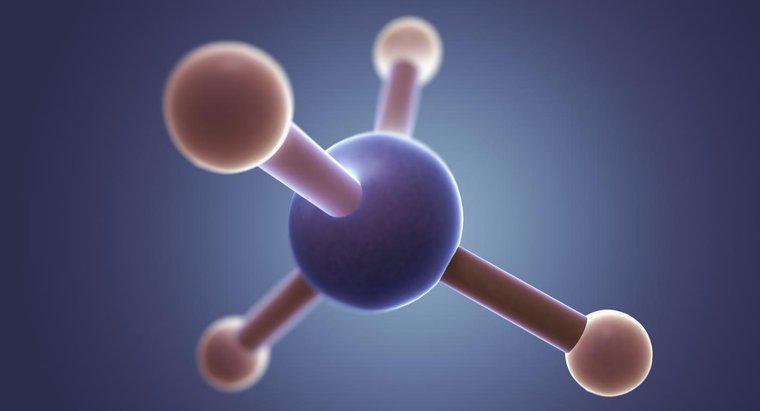
A estrutura de Lewis para CH3Br tem o carbono no centro com quatro elétrons ao redor e os três hidrogênios e bromo, cada um compartilhando um único elétron com o carbono. O bromo tem três pares adicionais de elétrons cercando-o.
As estruturas de Lewis mostram como os átomos se ligam para formar uma molécula completa e são úteis para demonstrar a ligação em moléculas básicas, como o bromometano. Em alguns casos, as linhas são usadas para indicar ligações, mas os pontos são mais comuns ao lidar com compostos básicos. Além dos elétrons de ligação, esses diagramas também mostram elétrons não ligados, como no caso do bromo no bromometano. O bromo, neste caso, tem três pares de elétrons que não estão ativamente envolvidos na ligação entre ele e o carbono.
Em geral, as estruturas de Lewis demonstram que a maioria dos átomos, com exceção do hidrogênio, forma moléculas para obter um total de oito elétrons em suas camadas externas. No entanto, essas estruturas também podem ser usadas para sugerir a forma geral de uma molécula. No caso do bromometano, os quatro átomos ao redor do carbono devem estar dispostos de maneira bastante uniforme em um espaço 3D, de modo que formem uma estrutura tetraédrica. No entanto, como o bromo forma uma ligação tão longa (e, portanto, mais fraca), os hidrogênios têm um pouco mais de espaço do que no metano, resultando em um tetraédrico levemente distorcido.