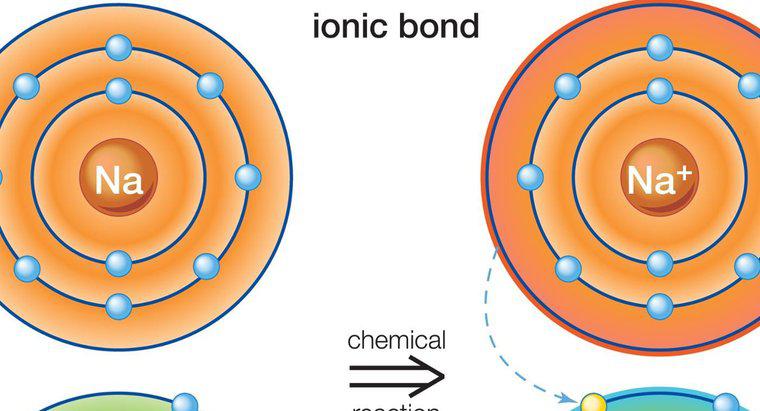
Os compostos iônicos se formam quando os elétrons são transferidos de um átomo para outro. Os compostos covalentes se formam quando os átomos compartilham elétrons, resultando em nenhuma perda ou ganho líquido de elétrons como visto em compostos iônicos.
Quando dois ou mais elementos químicos diferentes se combinam, eles formam um composto. Como esses átomos se combinam ou se unem depende do elemento e de suas características. A ligação que mantém os átomos juntos determina o tipo de composto que é, e estes podem ser iônicos ou covalentes.
Noções básicas de colagem Os átomos são classificados e caracterizados pelo número de elétrons que contêm. Cada elemento possui um número diferente de elétrons alojados nos orbitais que circundam o núcleo. O orbital externo é conhecido como orbital de valência e esses elétrons são usados no processo de ligação. Cada átomo busca ter um orbital externo completo de elétrons para ser estável. Para a maioria dos átomos, esse orbital externo contém oito elétrons. A regra do octeto se refere ao requisito de elétrons para ganhar, perder ou compartilhar elétrons a fim de preencher o orbital externo. Quando os átomos ganham ou doam elétrons para outro elemento, eles formam compostos iônicos. Quando os átomos compartilham elétrons com outro elemento, eles formam compostos covalentes.
Compostos Iônicos
Compostos iônicos se formam entre metais e não metais. Os metais normalmente têm poucos elétrons de valência no orbital externo, enquanto os não metais têm muitos. O metal atua como um doador e transfere seus elétrons de valência para o não metal, satisfazendo assim a regra do octeto necessária para formar um átomo estável. Isso resulta em um átomo metálico carregado positivamente e um átomo não metálico carregado negativamente, conhecido como íons. Por causa das cargas opostas, os dois íons são atraídos um para o outro e ficam próximos, formando um composto iônico. Mais de um elétron pode ser transferido neste processo. Como os átomos carregados flutuam livremente, eles são atraídos por outros átomos com carga oposta, não apenas pelo átomo único do qual doaram ou receberam elétrons.
As características dos compostos iônicos são que eles são sólidos cristalinos com altos pontos de fusão e ebulição. Eles conduzem eletricidade quando derretidos e são solúveis em água, mas não em líquidos apolares. Um dos compostos iônicos mais comuns é o cloreto de sódio (NaCl), também conhecido como sal de cozinha.
Compostos Covalentes
Em contraste, os compostos covalentes ocorrem normalmente entre não metais ou dois átomos do mesmo elemento ou de elementos semelhantes. Átomos com eletronegatividades semelhantes, que podem ser determinadas na tabela periódica, tendem a se atrair e formar ligações covalentes. Em vez de transferir os elétrons de valência completamente, os átomos compartilham os elétrons externos para satisfazer a regra do octeto. Os elétrons compartilhados podem se mover para frente e para trás entre os átomos ligados. Nenhum átomo está ganhando ou perdendo um elétron neste tipo de ligação, então nenhum íon é formado. Por causa disso, os átomos no composto não são atraídos por outros átomos próximos, como aqueles vistos em compostos iônicos.
Os compostos covalentes podem ser sólidos, líquidos ou gases. Eles tendem a ser maus condutores elétricos e têm baixos pontos de fusão e ebulição. Eles tendem a ser solúveis em líquidos não polares, mas não em água. Alguns exemplos comuns de compostos covalentes são metano (CH4) e dióxido de carbono (CO2).