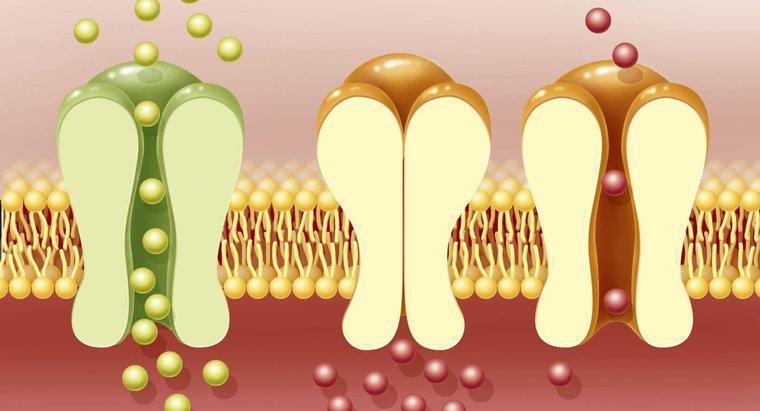
Os dois tipos básicos de células eletroquímicas são células galvânicas e células eletrolíticas, de acordo com UC Davis. As células galvânicas sofrem reações químicas espontâneas e liberam energia elétrica, enquanto as células eletrolíticas consomem eletricidade para fornecer energia não espontânea reações químicas. Ambos os tipos requerem um ânodo, um cátodo, soluções eletrolíticas e uma ponte de sal.
Células galvânicas incluem dispositivos como baterias não recarregáveis. Esses dispositivos criam um fluxo de elétrons de um eletrodo para outro, geralmente feito de dois metais diferentes. Em uma célula galvânica, os elétrons fluem do ânodo para o cátodo. Durante este processo, o ânodo libera íons de metal em um líquido ou solução de gel circundante, o eletrólito. Quando os elétrons fluem para o cátodo, eles são absorvidos pelos íons de metal na solução que os rodeia, e os íons perdem sua carga e se tornam átomos de metal padrão.
As baterias recarregáveis atuam como células eletrolíticas enquanto estão sendo carregadas e células galvânicas quando estão alimentando dispositivos, de acordo com UC Davis. Uma célula eletrolítica usa eletricidade para forçar uma reação química a ocorrer na direção oposta que ocorreria espontaneamente. Assim, a reação química que ocorre em uma bateria de recarga é exatamente o oposto da reação que ocorre quando a bateria libera energia.