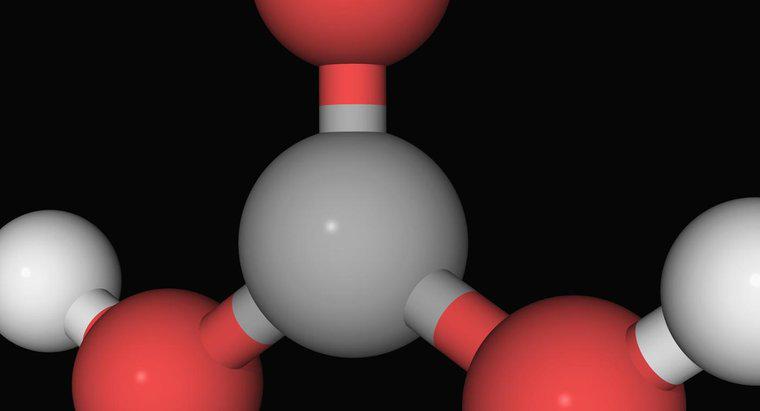
A definição de Arrhenius de um ácido é um composto que aumenta o número de íons de hidrogênio carregados positivamente, H +, quando adicionado à água. De acordo com Arrhenius, uma base é qualquer substância que resulta no aumento de íons hidróxido carregados negativamente, OH-, quando combinada com água.
Essas definições foram desenvolvidas em 1884 por Svante Arrhenius, um químico da Suécia.
A definição de Arrhenius de ácidos e bases é uma das duas definições regularmente aceitas. A outra é a definição de Bronsted-Lowry, que descreve um ácido como qualquer composto que emite prótons em uma solução aquosa e uma base como um composto que aceita prótons adicionais.