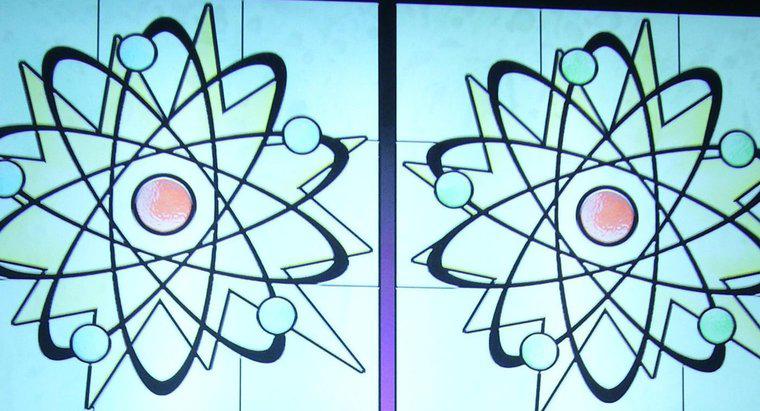
O número atômico de um átomo é o número de prótons que reside no núcleo, enquanto o número de massa é o número de prótons e nêutrons combinados. O número atômico determina o tipo de elemento de um átomo , enquanto o número de nêutrons determina o isótopo do elemento. Muitos elementos ocorrem naturalmente na forma de vários isótopos diferentes.
Todos os átomos possuem um núcleo, composto por um aglomerado de prótons e nêutrons, bem como uma “nuvem” de elétrons que circunda o núcleo. Os prótons são partículas carregadas positivamente, os nêutrons são partículas sem carga e os elétrons são partículas com carga negativa.
Na maioria das circunstâncias, a carga líquida de um átomo é neutra porque os prótons e nêutrons são encontrados em quantidades idênticas. Quando um átomo ganha ou perde um elétron, o átomo se torna um íon carregado. Se um elétron é perdido, o átomo torna-se positivamente carregado; no entanto, se ele ganhar um elétron, o átomo ficará carregado negativamente.
Se um átomo perder um nêutron e se tornar um isótopo, suas propriedades podem ser diferentes daquelas que estão na configuração natural. Freqüentemente, os átomos que são radioativos passam por um processo de decaimento que resulta na perda de seus nêutrons do átomo.