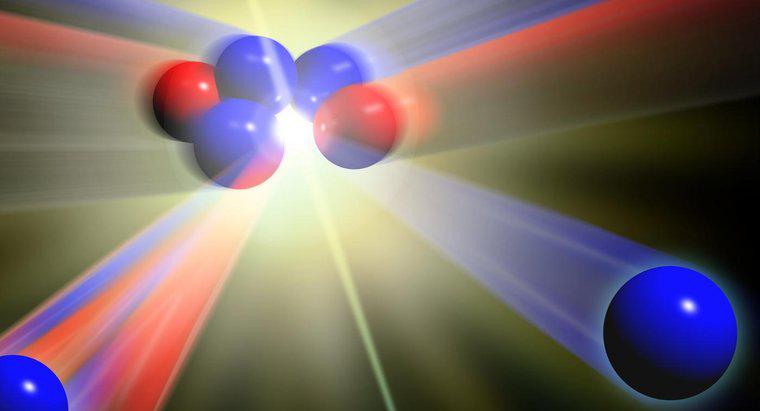
A diferença entre átomos, íons e isótopos é o número de partículas subatômicas. Um átomo é o bloco de construção básico da matéria, a menor molécula de um elemento que existe e que não pode ser quimicamente dividido por meios comuns. Cada átomo é composto de prótons, nêutrons e elétrons. Em íons, o número de elétrons difere, e em isótopos, o número de nêutrons varia.
De acordo com Visionlearning.com, um átomo típico não tem carga elétrica porque o número de prótons carregados positivamente é igual ao número de elétrons carregados negativamente. O número de elétrons em um átomo pode mudar, porém, ganhando elétrons adicionais de outros átomos ou dando um ou mais de seus elétrons para átomos próximos. Quando o número de elétrons de um átomo muda, o átomo carrega uma carga elétrica. Este átomo eletricamente carregado é conhecido como íon.
Normalmente, um átomo tem o mesmo número de prótons e nêutrons. Alguns átomos ganham ou perdem um nêutron. Quando o número de nêutrons em um átomo muda, um isótopo é formado. Os isótopos de um átomo têm massas atômicas diferentes e exibem propriedades diferentes, mas ainda são o mesmo elemento.
Os átomos de um elemento sempre têm o mesmo número de prótons.