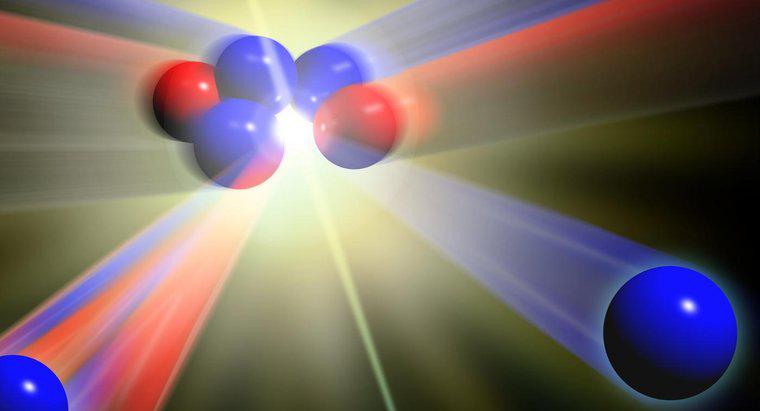
Átomos do mesmo elemento que têm massas diferentes são chamados de isótopos. Massas diferentes resultam quando há diferentes números de nêutrons. Todos os átomos de um determinado elemento têm o mesmo número de prótons.
Para identificar os diferentes isótopos de um elemento, o símbolo do elemento é escrito seguido pelo número de nêutrons. Por exemplo, dois isótopos comuns de urânio são escritos como U-236 e U-238.
Um átomo normalmente tem o mesmo número de nêutrons e elétrons que o número de prótons. Quando um átomo tem um número diferente de elétrons, a carga elétrica do átomo torna-se positiva, se menos elétrons estiverem presentes, ou negativa, se elétrons adicionais estiverem presentes. Os átomos com carga positiva ou negativa são chamados de íons. Quando um átomo tem um número diferente de nêutrons, porque os nêutrons não têm carga elétrica, a carga elétrica do átomo não é afetada. No entanto, os isótopos têm um peso atômico diferente.
Na tabela periódica, o peso atômico, ou massa atômica, é dado para cada elemento. O número não é um número inteiro, pois reflete a abundância natural de isótopos de um elemento. Por exemplo, a massa atômica do hidrogênio é 4,003. Em cálculos de química, a massa atômica é usada com a suposição de que uma amostra do elemento inclui a gama natural de isótopos para o elemento.