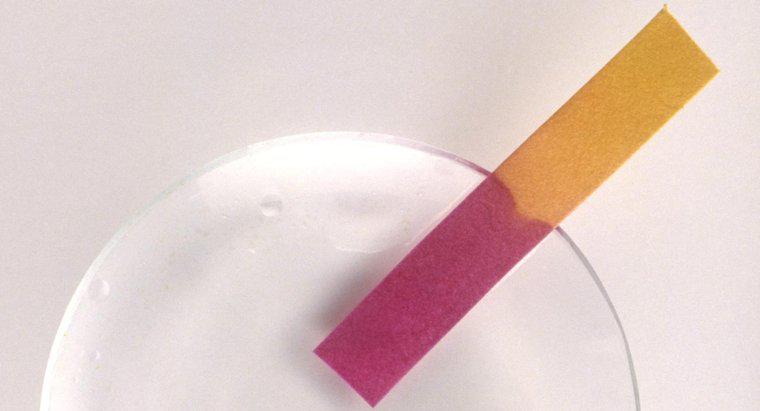Fisicamente, os ácidos têm um sabor azedo, são solúveis em água, tornam-se vermelhos como papel de tornassol azul, são corrosivos, têm valores de pH inferiores a 7 e conduzem eletricidade. Estas propriedades físicas dos ácidos são um subproduto das propriedades químicas dos ácidos. Os ácidos podem ser soluções ou substâncias puras e podem ser de natureza sólida, líquida ou gasosa.
Ácidos são definidos como substâncias que aumentam a concentração de átomos de hidrogênio, ou mais precisamente, átomos de hidrônio (H30), na água. Essa ionização do ácido, que é típica de todos os sais, é a razão pela qual os ácidos conduzem eletricidade. Os valores de pH são definidos como o logaritmo negativo da concentração de átomos de hidrônio em uma solução; assim, os ácidos fornecem um valor de pH menor que 7 porque as concentrações de hidrônio são maiores que 10 ^ -7 moles por litro. A força de um ácido e, portanto, sua corrosividade, é determinada pelo quanto um ácido se ioniza, ou se dissocia, em átomos de hidrônio na água, com ácidos fortes se dissociando completamente e ácidos fracos apenas parcialmente. Esses átomos de hidrônio reagem quimicamente com metais e tecidos vivos. Essa propriedade corrosiva é útil no corpo humano, pois o ácido do estômago auxilia na digestão dos alimentos. Ácidos fracos também são usados como aditivos em alimentos para infundir um sabor azedo.