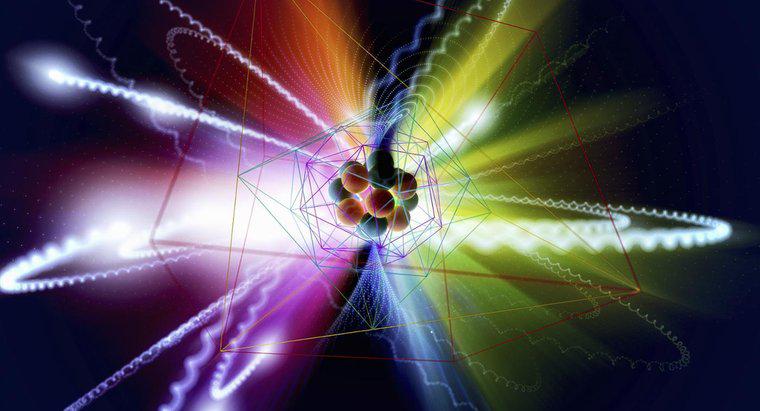
O modelo de esfera sólida proposto por John Dalton afirmou que os átomos consistiam em cargas negativas embutidas em um contínuo sólido de carga positiva. A magnitude da carga negativa embutida cancelaria a carga positiva do contínuo, tornando todo o átomo neutro.
O modelo de Dalton foi apresentado em 1803 e formulou a hipótese de que todos os elementos são feitos de esferas sólidas indivisíveis de átomos. O modelo foi um dos primeiros a propor que os átomos do mesmo elemento são idênticos, que todos os átomos de um elemento são indistinguíveis de todos os outros átomos desse elemento. O modelo também descreveu com precisão os compostos como proporções fixas dos átomos de diferentes elementos combinados. Embora o modelo propusesse que as reações químicas resultam da combinação ou separação de átomos, ele não explicava como essas reações químicas poderiam ocorrer. O modelo também propôs que os átomos de um elemento nunca são transformados em átomos de outro elemento, o que não é verdade.
Para organizar os elementos, Dalton criou uma tabela de pesos atômicos, uma precursora da tabela periódica moderna. Os elementos foram organizados com base em seus pesos atômicos em relação ao peso de um átomo de hidrogênio, ao qual ele atribuiu um número atômico de um, uma prática que a tabela moderna também adotou.