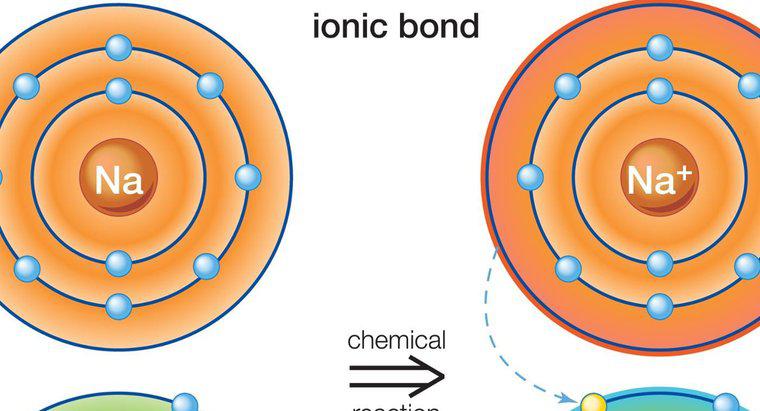
Soluções aquosas de compostos iônicos são bons condutores de eletricidade, enquanto soluções de compostos moleculares não. Isso é verdade porque os íons individuais em compostos iônicos podem se dissociar completamente na água com as moléculas permanecendo inteiras. Os compostos iônicos e moleculares também afetam os pontos de ebulição e fusão da água.
Os compostos iônicos se dissolvem mais facilmente na água do que os compostos moleculares, embora haja exceções a essa regra. A água é usada como padrão para determinar a solubilidade de um composto porque é altamente polar e pode dissolver mais compostos do que qualquer outro solvente, dando-lhe o título de solvente universal. Os compostos iônicos conduzem eletricidade quando se dissociam porque facilitam a transferência de elétrons. A diferença nas cargas das partículas permite que os elétrons livres saltem facilmente de uma partícula para outra. As moléculas compartilham seus elétrons e têm uma carga geral neutra que não permite muita condutividade.
Os compostos iônicos têm pontos de fusão e ebulição altos, enquanto os compostos moleculares têm pontos de fusão e ebulição relativamente baixos. Essas propriedades são transferidas para a água quando os compostos se dissolvem nela. Os compostos iônicos dissociados aumentam o ponto de fusão e diminuem o ponto de congelamento da água. Os compostos moleculares geralmente têm o efeito oposto se se dissolverem na água.