Os compostos iônicos conduzem eletricidade quando dissolvidos na água porque o movimento de suas partículas carregadas negativamente e positivamente forma uma corrente elétrica, explica About.com. Neste estado líquido, os íons carregados se separam e se movem livremente, criando uma corrente de partículas elétricas que conduzem eletricidade.
A condutividade elétrica mede a capacidade de uma substância de produzir corrente elétrica, enquanto a eletricidade é o movimento de partículas carregadas que formam essa corrente elétrica. Uma corrente, no reino elétrico, é simplesmente um fluxo de cargas que requer movimento livre. Para que a corrente elétrica se forme, o movimento e a condutividade devem estar presentes.
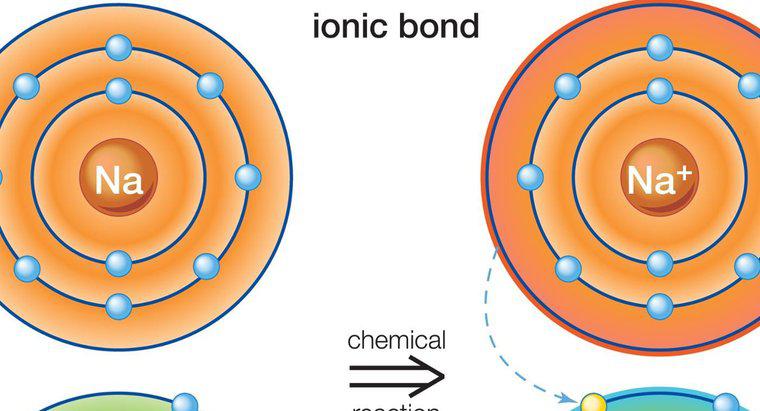
Os compostos iônicos são formados quando íons carregados positivamente e negativamente são ligados intimamente. Esses íons são átomos que ganharam ou perderam um elétron e se unem pela transferência de um elétron em um processo chamado ligação iônica. Um íon carregado positivamente é um cátion, enquanto um íon carregado negativamente é um ânion. Um exemplo de um composto iônico é o cloreto de sódio, NaCl, em que o sódio (NA) é o cátion e o cloro (Cl) é o ânion.
Os compostos iônicos em seu estado sólido têm partículas que são mantidas juntas, restringindo todo o movimento e evitando a formação de corrente elétrica. Conseqüentemente, os sólidos iônicos não conduzem eletricidade. Quando dissolvido em água, a ligação iônica é quebrada, o que permite que os íons carregados sejam separados e fluam livremente. A água fornece o movimento das partículas e os íons separados fornecem a condutividade. Uma vez que ambos estão presentes, uma corrente elétrica é criada para conduzir eletricidade.