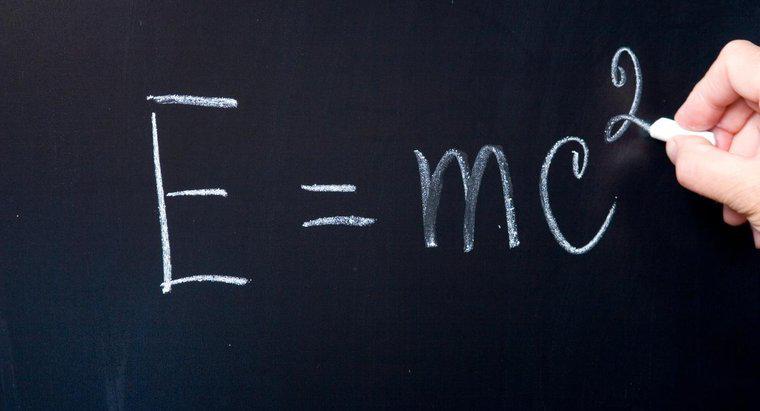Um único nêutron tem uma massa de 1.008665 unidades de massa atômica. Uma unidade de massa atômica é uma unidade muito pequena de massa igual a um duodécimo da massa de um átomo de carbono-12. Os nêutrons têm uma massa ligeiramente maior do que os prótons, que têm uma massa de 1,007277 unidades de massa atômica.
A massa de nêutrons e prótons pode ser usada para calcular a massa atômica de um átomo, que é igual à massa combinada dos nêutrons e prótons em seu núcleo. A massa atômica, que é expressa em unidades de massa atômica, pode ser calculada multiplicando o número de nêutrons por 1,008665 e o número de prótons por 1,007277 e, em seguida, adicionando esses dois produtos.
Os nêutrons são partículas atômicas que carregam uma carga neutra e são encontradas nos núcleos dos átomos. Os átomos de um elemento que contêm diferentes números de nêutrons são chamados de isótopos. A massa atômica média de um elemento é calculada multiplicando-se a massa de cada isótopo por sua abundância relativa na natureza e, em seguida, adicionando esses produtos. Geralmente, a massa atômica exibida para cada elemento na tabela periódica é a massa média de todos os seus isótopos naturais. Às vezes, a massa atômica é arredondada para o número inteiro mais próximo; este número é conhecido como o número de massa de um elemento.