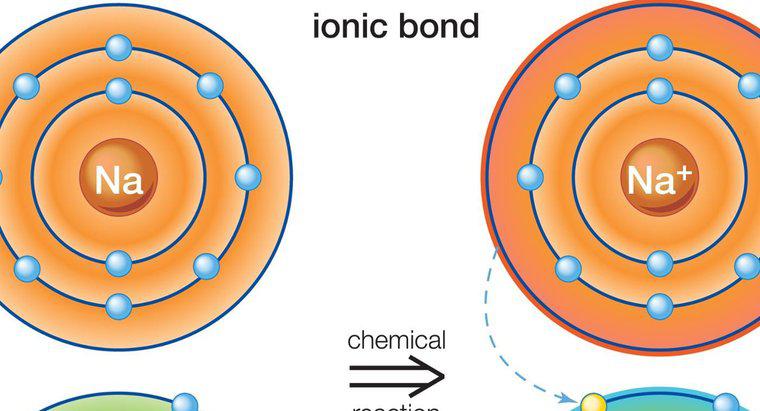
Como são o resultado da atração entre cargas parciais em vez de cargas completas, as ligações de hidrogênio são muito mais fracas do que as ligações iônicas ou covalentes. As ligações iônicas e covalentes atraem os átomos de diferentes substâncias para formar as moléculas dos compostos, enquanto as ligações de hidrogênio são forças que tendem a atrair as moléculas umas para as outras. Um exemplo de ligação de hidrogênio é a atração entre moléculas de água individuais, enquanto a atração entre os átomos de hidrogênio e oxigênio dentro de cada molécula de água representa a ligação covalente.
Uma ligação de hidrogênio é formada quando um átomo de hidrogênio polarizado positivamente em uma molécula é atraído por um átomo altamente eletronegativo em outra molécula. No exemplo das moléculas de água, o átomo de oxigênio carregado negativamente em uma molécula de água atrai o átomo de hidrogênio carregado positivamente em outra molécula de água. Os átomos de oxigênio tendem a roubar elétrons dos átomos de hidrogênio dentro das moléculas. Quando isso ocorre dentro de uma molécula de água, a perda de elétrons cria um átomo de hidrogênio com carga positiva parcial, que é então atraído por um átomo de oxigênio carregado negativamente em outra molécula de água.
As ligações de hidrogênio que se formam entre as moléculas de água fazem com que elas se colem. Isso dá à água uma temperatura de ponto de ebulição alto porque um grau maior de energia térmica é necessário para quebrar as ligações de hidrogênio intermoleculares. Muitas substâncias orgânicas necessárias para sustentar a vida, como ácidos nucléicos e proteínas, contêm ligações de hidrogênio. Embora essas ligações sejam mais fracas do que as ligações iônicas ou covalentes internas existentes entre os átomos dentro das moléculas, a força acumulada das ligações de hidrogênio nos organismos vivos é altamente significativa e desempenha um papel importante na manutenção da estabilidade.