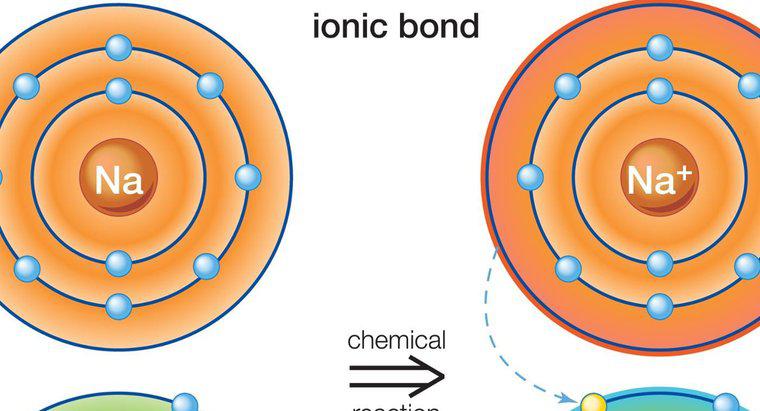
Átomos maiores com orbitais de elétrons complexos, como aqueles encontrados nos metais de transição, são capazes de exceder a regra do octeto nas condições certas. Em particular, eles ocorrem quando os elementos mais pesados estão ligados a elementos pequenos e altamente eletronegativos como flúor, cloro ou oxigênio. Um exemplo é o pentacloreto de fósforo, um único átomo de fósforo ligado a cinco átomos de cloro, que tem 10 elétrons compartilhados em sua camada de valência externa.
Quando um elemento tem um número atômico alto o suficiente, um novo tipo de orbital de elétrons está disponível com capacidade para até 10 elétrons, permitindo até cinco ligações simples. É o que ocorre com o pentacloreto de fósforo. Para fazer uso desse orbital, no entanto, a reação que cria o composto que usa esse orbital deve ser energeticamente muito favorável. É por isso que, para que funcione, devem estar envolvidos elementos com uma capacidade muito forte de atrair e ligar elétrons, também conhecida como eletronegatividade. O oxigênio tem alta eletronegatividade, mas é improvável que crie um composto com cinco átomos ligados como o cloro, porque requer dois elétrons para completar sua camada externa de valência. O flúor e o cloro requerem apenas um, portanto, tornam esse tipo de configuração mais provável.