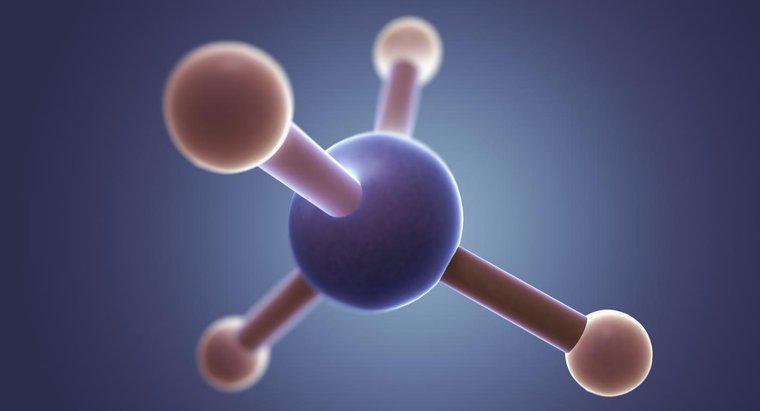
O cloreto de metila (CH3Cl) tem uma forma tetraédrica com um ângulo de ligação de 109,5 graus. Isso ocorre porque o carbono tem quatro elétrons de valência formando quatro ligações e, em um espaço tridimensional, uma forma tetraédrica permite que os elétrons ligados fiquem mais distantes uns dos outros.
As formas moleculares são previstas usando a teoria de repulsão do par de elétrons da camada de valência (VSEPR). Segundo o VSEPR, as moléculas terão uma forma geométrica que permite que seus centros de carga negativa (elétrons de pares unidos e solitários) fiquem o mais distantes possível, devido à repulsão mútua das cargas negativas. Moléculas com dois centros negativos tendem a ser lineares (um ângulo de ligação de 180 graus em um plano bidimensional). As moléculas com três centros negativos são trigonais planares (ângulos de ligação de 120 graus em um plano bidimensional) e as moléculas com quatro centros negativos são tetraédricas (ângulos de ligação de 108,5 graus em um espaço tridimensional).
O cloreto de metila tem um átomo de carbono central rodeado por quatro ligações simples (três para hidrogênio e uma para cloro). Portanto, de acordo com o VSEPR, a molécula terá uma forma tetraédrica com um ângulo de ligação de 108,5 graus para permitir a separação máxima dos elétrons ligados.