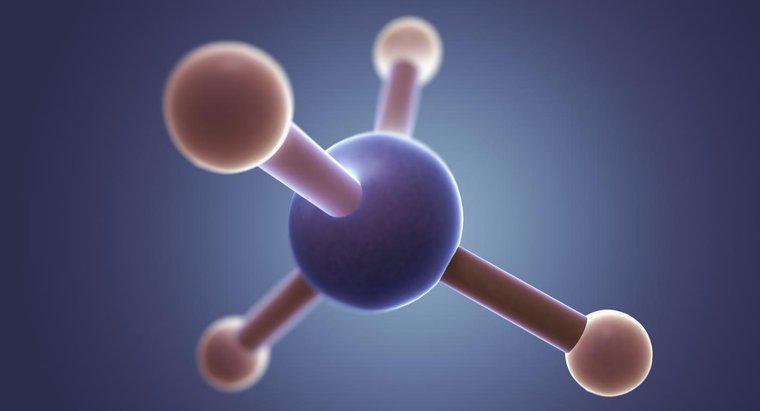
A estrutura de Lewis de CS2 consiste em um único átomo de carbono com um átomo de enxofre em cada lado. As ligações na estrutura de Lewis são uma ligação dupla conectando o átomo de carbono a cada átomo de enxofre, ou um átomo de enxofre conectando-se com uma ligação tripla e o outro com uma ligação simples.
Estruturas de Lewis para moléculas são tipicamente escritas por tentativa e erro, a menos que já sejam conhecidas. O método para descobrir uma estrutura de Lewis requer que todos os elétrons de valência sejam contabilizados e todos os átomos na estrutura terminem com uma camada completa de elétrons de valência.
Primeiro, conecte todos os átomos usando a eletronegatividade dos elementos para determinar quais átomos vão para onde. Normalmente, se você tiver um átomo de carbono e vários outros átomos, o átomo de carbono estará no centro. No caso de CS2, o átomo de carbono é menos eletronegativo e forma o centro.
A seguir, determine quantos elétrons estão presentes. Em CS2, os átomos de enxofre contribuem com seis elétrons de valência cada e o átomo de carbono contribui com quatro para um total de dezesseis. 24 elétrons seriam necessários para fornecer aos três átomos uma camada de valência completa de 8 elétrons. Isso significa que a molécula CS2 deve ter um total de 8 ligações conectando os três átomos.