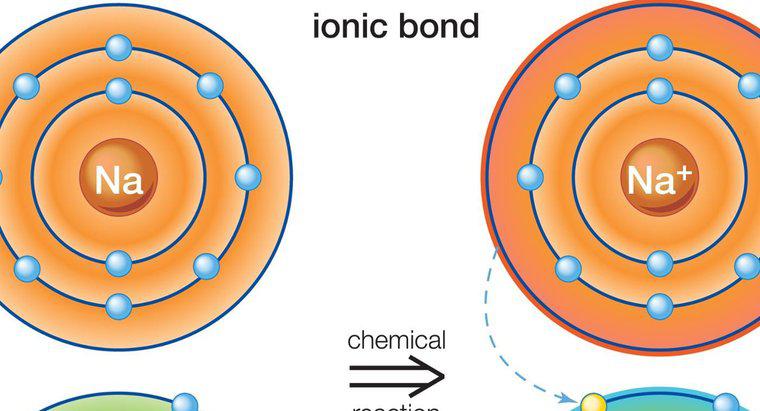
Uma ligação iônica é um tipo de ligação química estabelecida entre dois átomos pela transferência dos elétrons de valência de um átomo para outro. Esse tipo de ligação também é conhecido como ligação eletrovalente ou polar. Os sais são um bom exemplo de substâncias feitas com ligações iônicas.
Uma ligação iônica envolve um metal e um átomo não metálico. Cada átomo tem a tendência de atingir a configuração eletrônica estável, o que significa atingir o número do octeto (2 ou 8) em sua camada de valência. O átomo de metal tem elétrons em excesso acima do número do octeto em sua camada de valência. Por outro lado, o átomo não metálico tem poucos elétrons e, portanto, precisa de elétrons para preencher seu octeto. Uma vez que eles se encontram, o átomo metálico entrega seus elétrons excedentes ao átomo não metálico. Como resultado dessa transferência de elétrons, cada um dos átomos atinge a configuração eletrônica estável. O composto é formado por esta ligação denominada composto iônico ou eletrovalente. Em ligações iônicas, a carga líquida do composto deve ser zero. Alguns exemplos de compostos iônicos são: NaCl (cloreto de sódio), MgO (óxido de magnésio), CaF2 (fluoreto de cálcio) e Al2O2 (óxido de alumínio). No mundo real, não se conhece a existência de compostos com ligações iônicas puras. Todos os compostos iônicos têm um grau de ligação covalente.