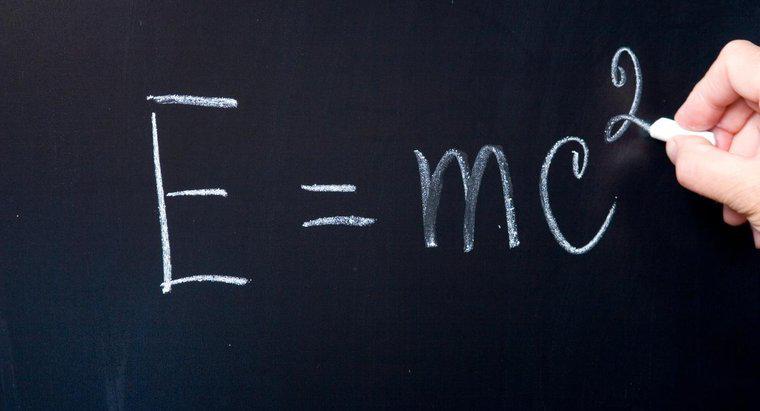O "nível de energia ocupada mais alta" significa o nível de energia em que residem os elétrons de valência. Os elementos seguem a regra do octeto, o que significa que eles desejam atingir o arranjo estável de ter oito elétrons em sua posição mais ocupada nível de energia. Alguns átomos querem abrir mão dos elétrons e outros querem ganhar elétrons para se tornarem mais estáveis.
Os elétrons de valência existem apenas nos orbitais sep de maior nível de energia. O princípio de Aufbau afirma que os elétrons devem preencher os níveis de energia mais baixos primeiro, antes de passar para o próximo nível de energia. Cada nível de energia tem um número específico de orbitais; apenas dois elétrons girando em direções opostas podem preencher cada orbital. Os elétrons existem em distâncias diferentes do núcleo do átomo. Os elétrons que ocupam orbitais mais próximos do núcleo têm menos energia do que aqueles que orbitam mais longe.
Os elementos mais estáveis da tabela periódica, os gases nobres, têm oito elétrons em seu nível de energia ocupado mais alto; os gases nobres não formam facilmente compostos com outros elementos. Os elétrons no nível de energia ocupado mais alto têm muito a ver com a reatividade do elemento. Elementos como os metais com poucos elétrons em seus níveis de energia mais elevados querem doá-los a outros elementos. Elementos como os não-metais têm quase um complemento total de oito elétrons em seus níveis de energia mais externos, então eles querem ganhar elétrons dos elementos.