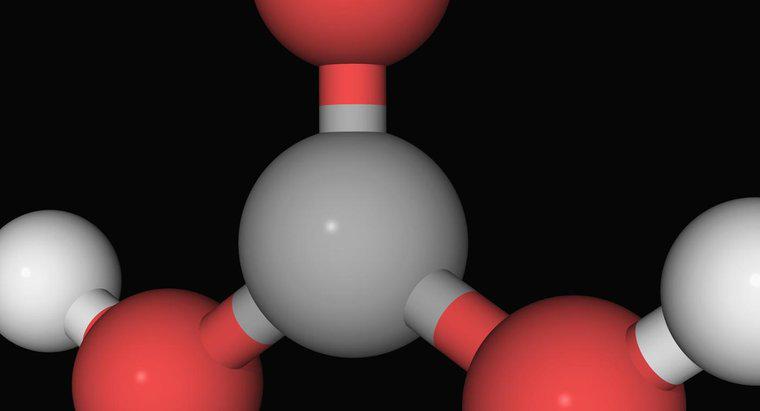
A neutralização de uma substância ácida é realizada combinando-a com uma substância básica, o que resulta na formação de água e um sal, explica UC Davis ChemWiki. A reação de neutralização ocorre devido ao ácido doando íons H + enquanto a base doa íons OH-.
Para uma solução ácido-base atingir a neutralização, a quantidade, ou mols, de íons H + deve ser equivalente ao número de mols de íons OH-, observa UC Davis ChemWiki. Assim, se houver quatro moles de íons H + no ácido, ele se neutraliza quando combinado com a quantidade necessária de base para fornecer quatro moles de íons OH-.
Uma vez que todos os íons H + e OH- são usados na reação sem íons remanescentes em excesso, a reação é considerada em seu ponto de equivalência, explica UC Davis ChemWiKi. Se o ácido e a base na reação forem fortes, a solução resultante terá um pH de sete. Se o ácido for forte enquanto a base for fraca, ocorre uma solução com pH inferior a sete. Por último, se o ácido for fraco enquanto a base for forte, a solução resultante terá um nível de pH superior a sete.
As substâncias usadas para neutralizar derramamentos químicos são geralmente fracas porque a reação de um ácido forte e uma base forte é violenta, explica o gerente de laboratório. Alguns neutralizadores contêm ingredientes que fazem com que um derramamento mude de cor para que os observadores possam dizer quando ocorre a neutralização.