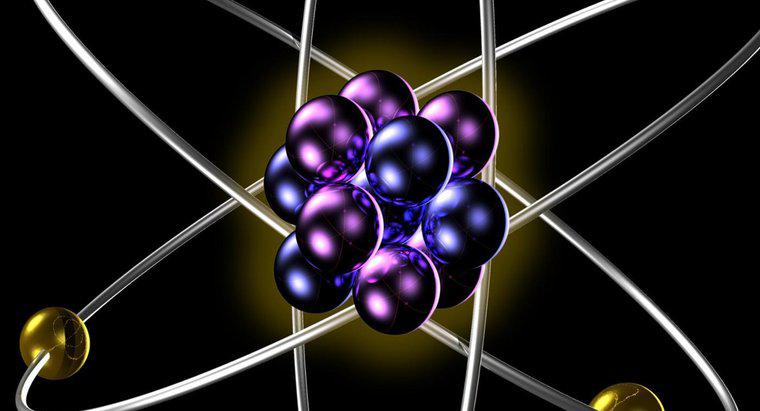
Isótopos do mesmo elemento têm o mesmo número de prótons e elétrons quando na forma atômica neutra. Isótopos diferentes têm números diferentes de nêutrons em seus núcleos, resultando em pesos atômicos diferentes para os diferentes isótopos de um único elemento.
O número de prótons no núcleo dos átomos de um elemento fornece a massa atômica desse elemento. A massa atômica é constante para todos os isótopos do elemento. Como a massa atômica determina o número de elétrons que devem orbitar o núcleo para que o átomo seja neutro, essa massa atômica determina o comportamento químico do elemento, já que toda química não nuclear resulta das interações das nuvens de elétrons de átomos com um outro. Isso significa que todos os isótopos do mesmo elemento participam da mesma maneira nas reações químicas.
Uma diferença no comportamento do isótopo surge quando os núcleos de certos isótopos são instáveis devido a um desequilíbrio no número de prótons para nêutrons no núcleo. Deve haver aproximadamente um nêutron para cada próton para que um núcleo atômico seja estável. À medida que o número de nêutrons aumenta desproporcionalmente ao número de prótons, o núcleo se torna instável, liberando esse excesso de peso de nêutrons na forma de partículas alfa e beta e radiação gama.